世上有一种罕见病,得上这种病,患者身体会控制不住地“跳舞”,脸部、手臂、躯体不自觉任意地扭动,伴随步态不稳、言语和吞咽障碍。更可怕的是,该病无法治愈,被认为是世界上最悲伤的“舞蹈”。这种病有一个好听的名字,叫做“亨廷顿舞蹈病”(Huntington’s disease,HD),又称亨廷顿病 。
近日,长三角绿色制药协同创新中心溶酶体新药研发团队杨俊晟博士作为第一作者和唯一通讯作者,在国际知名期刊Autophagy上发表了题为“A prion-like domain of TFEB mediates the co-aggregation of TFEB and mHTT”的学术论文,报道了亨廷顿病(HD)致病蛋白mHTT与溶酶体生物生成和自噬的主要调节因子TFEB(转录因子 EB)形成共聚集体并可能干扰其功能,并揭示这一现象是由TFEB上的一段朊病毒样结构域(PrLD)介导的。
HD是目前已知病因最为明确的神经退行性疾病之一,由Huntingtin基因(编码HTT蛋白)的突变导致。相较于正常HTT,突变的HTT蛋白(mHTT)容易形成聚集体,并容易将细胞中其他蛋白也引入其中,从而影响细胞的正常功能。因此HD研究的一个主要方向是设法降低mHTT水平。
转录因子EB(TFEB)作为溶酶体生物生成和自噬的主要调节因子,可以调控溶酶体与自噬功能,帮助细胞降解蛋白聚集体等“垃圾”,因此被认为是治疗包括HD在内的神经退行性疾病的潜在靶点。此前陆续有研究报道TFEB的过量表达有助于HD模型细胞减少mHTT,但在HD小鼠模型中,有研究发现TFEB的过量表达并未起到预想的降低mHTT以缓解HD症状的效果。这一现象颇令人费解。
作者发现,mHTT形成的聚集体,可通过TFEB上的一段特异氨基酸序列——朊病毒样结构域(PrLD)——将TFEB也囊括进聚集体中,并影响其功能(图1)。这一现象在HD小鼠的模型中也得到了验证。这很可能就是为什么TFEB的过表达在小鼠中未取得预期效果的原因。
“神经退行性疾病治疗的一个难点是,如mHTT这样的致病蛋白可能会直接损害细胞用来对抗它们的机制,降低细胞应对它们的能力,从而使致病蛋白进一步积累,令细胞进入一种恶性循环,导致疾病的加速进展。”杨俊晟介绍说。
“但我们也不必因此太沮丧,” 杨俊晟进一步解释道,“结合此前报道的TFEB对降低可溶性mHTT的作用,TFEB 激活可能对治疗早期HD患者更有价值,而对晚期患者的严重mHTT聚集,则可能很难起到预期的作用。另一方面,与TFEB同一家族的转录因子TFE3在功能上跟TFEB有一定的重叠性,但TFE3并不包含PrLD也不会与mHTT共聚集,因此TFE3可能可以作为治疗HD的替代靶点。”
本文通讯作者杨俊晟研究HD已有近十年的时间。此前他在酵母模型中发现了mHTT不同构象对细胞骨架可能存在的破坏作用以及细胞内相应的调控机制。2021年,他已在Autophagy发表观点性文章,提出了HD中自噬功能缺陷的一种新的模型(图2)。
该工作获得了国家自然科学基金面上项目(82071432),浙江省自然科学基金探索项目(LY20H090019)以及绿色制药协同创新中心青年英才重点项目的支持,由杨俊晟博士带领中心硕士研究生徐慧琳、张超越等共同完成。
《Autophagy(自噬)》是自噬领域的权威期刊,由美国科学家Daniel Klionsky教授于2005年创办,主要关注发表自噬的机制及其与人类健康和疾病的联系。最新影响因子为16.016。
杨俊晟,长三角绿色制药协同创新中心助理研究员、硕士研究生导师。本科毕业于北京大学生物化学及分子生物学系,2001年毕业后赴美国留学,2008年于南加州大学获得分子生物学博士学位。后赴瑞典哥德堡大学从事博士后研究,于2018年底入职长三角绿色制药协同创新中心。长期从事衰老的细胞分子生物学以及相关疾病de研究,包括HD的潜在治疗靶点、溶酶体离子通道的小分子激动剂/抑制剂对衰老和疾病的缓解作用等。在Cell及子刊,Nature Cell Biology, eLife, PNAS, Autophagy等国际顶级杂志先后参与发表SCI收录学术论文24篇,其中以第一或通讯作者发表论文共9篇。
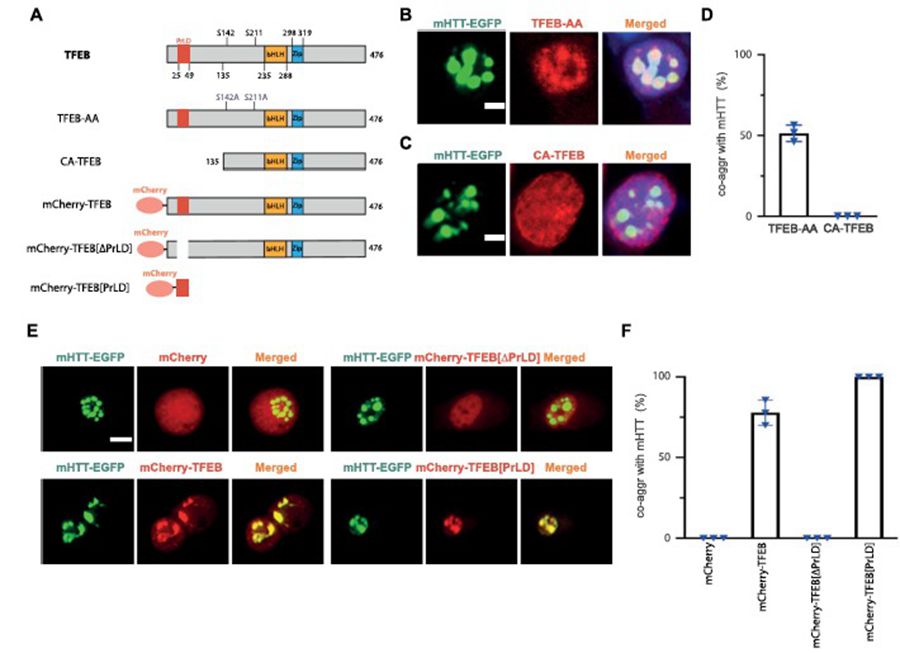
TFEB的PrLD介导了mHTT与TFEB的共聚集
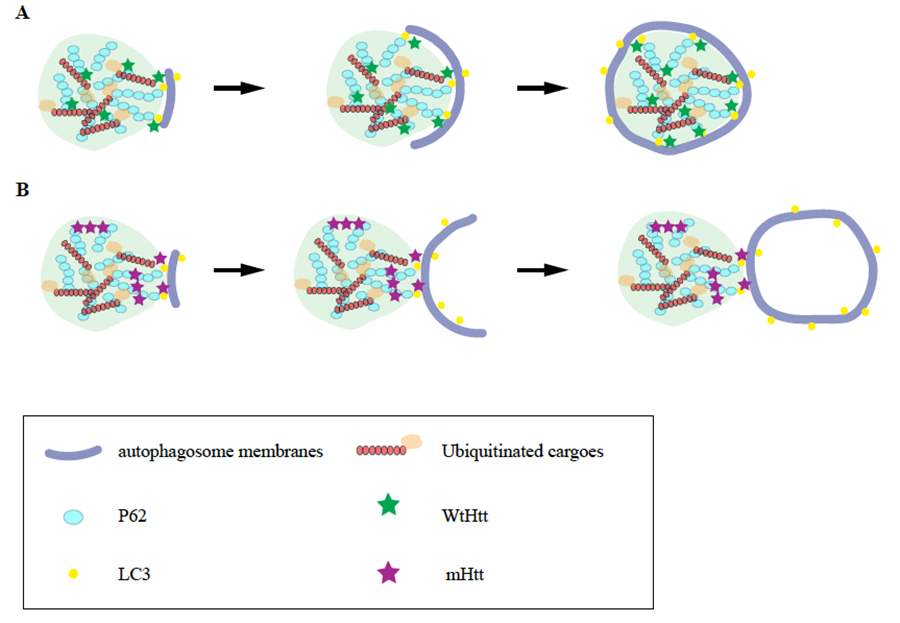
HD中自噬缺陷的两种模型
论文链接:https://doi.org/10.1080/15548627.2022.2083857
 校历
校历 邮箱
邮箱 EN
EN

 浙公网安备 33010302002621号
浙公网安备 33010302002621号